О лаборатории
Основные направления деятельности:
- Биоэлектрохимические системы: микробные и ферментные топливные элементы различной конструкции и назначения для практического использования в экобиотехнологии.
- Применение наноматериалов для модификации биоэлектродов и биокатализаторов с целью увеличения эффективности функционирования биоэлектрохимических систем и получения новых свойств биокатализаторов.
- Поиск специфических оксидаз и направленное изменение свойств ферментов с использованием методов молекулярной биотехнологии для применения в биоэлектрохимических системах и медицинской биотехнологии.
- Закономерности функционирования свободных и инкапсулированных микроорганизмов в процессах биотрансформации и биодеградации различных загрязнителей.
Состав лаборатории
Подробнее о сотрудниках лаборатории можно узнать в разделе Структурные подразделения.
| Алферов Сергей Валерьевич | Кандидат химических наук | Заведующий лабораторией |
| Лаврова Дарья Геннадьевна | Кандидат химических наук | Старший научный сотрудник |
| Егоров Константин Алексеевич | Магистрант каф. БТ | Младший научный сотрудник |
| Захаров Никита Сергеевич | Магистрант каф. БТ | Младший научный сотрудник |
| Ковалева Алина Александровна | Магистрант каф. Химия | Младший научный сотрудник |
| Лепикаш Роман Владимирович | Аспирант кафедры БТ | Младший научный сотрудник |
| Оськин Павел Владимирович | Магистрант каф. Химия | Младший научный сотрудник |
| Федина Вероника Вячеславовна | – | Младший научный сотрудник |
| Филиппова Анастасия Сергеевна | Магистрант каф. БТ | Младший научный сотрудник |
| Филиппова Екатерина Сергеевна | Магистрант каф. БТ | Младший научный сотрудник |
Последние публикации в журналах, индексируемых в международных базах данных Web of Science/Scopus. квартиль Q1
| State of the Art and Environmental Aspects of Plant Microbial Fuel Cells’ Application Lepikash, R.; Lavrova, D.; Stom, D.; Meshalkin, V.; Ponamoreva, O.; Alferov, S. State of the Art and Environmental Aspects of Plant Microbial Fuel Cells’ Application. Energies 2024, 17, 752. https://doi.org/10.3390/en17030752 Загрязнение окружающей среды становится повсеместным; это оказывает негативное влияние на разнообразие экосистем и ухудшает качество жизни человека. В обзоре обсуждается возможность применения технологии растительных микробных топливных элементов (РМТЭ) для параллельных процессов выработки электроэнергии и очистки водных и почвенных экосистем от органических загрязнителей, в частности от синтетических ПАВ и тяжелых металлов. В обзоре описаны механизмы функционирования РМТЭ и освещены вопросы экологического применения РМТЭ. В целом, в этой работе обобщены различные подходы к разработке РМТЭ и потенциальному использованию таких гибридных биоэлектрохимических систем для защиты окружающей среды. | 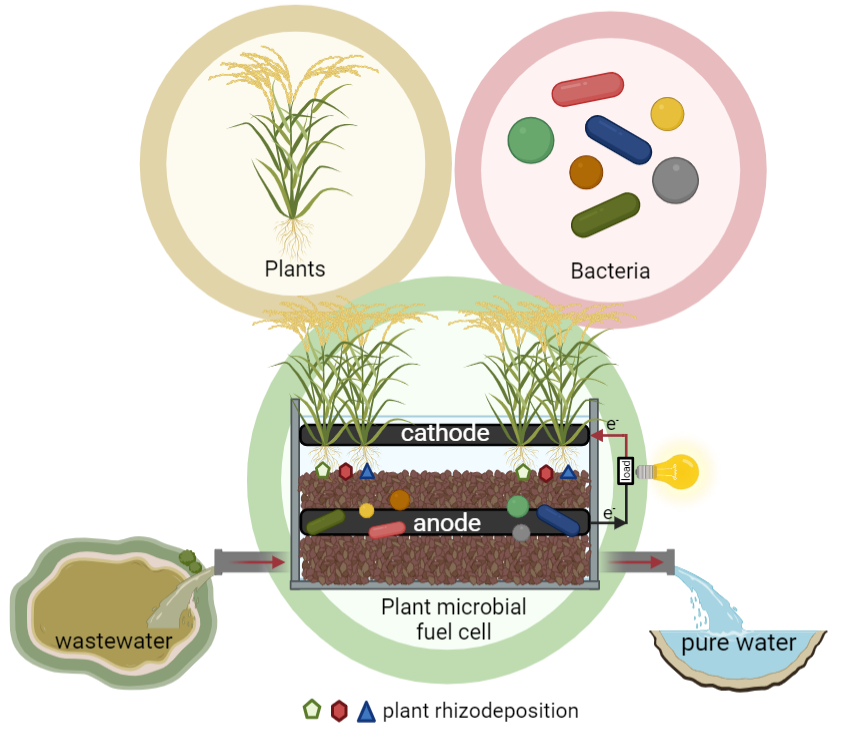 |
| Functionalization of MWCNTs for Bioelectrocatalysis by Bacterial Two-Domain Laccase from Catenuloplanes japonicas Abdullatypov, A.; Oskin, P.; Fedina, V.; Trubitsina, L.; Yakimovich, S.; Shuvalova, E.; Verma, P.; Dyachkova, T.; Ponamoreva, O.; Alferov, S. Functionalization of MWCNTs for Bioelectrocatalysis by Bacterial Two-Domain Laccase from Catenuloplanes japonicus. Nanomaterials 2023, 13, 3019. https://doi.org/10.3390/nano13233019 Исследование было проведено с целью оценки нескольких модификаций наноматериалов на основе углеродных нанотрубок для их применения в лакказных электродах и модельных биотопливных элементах. Модифицированные МУНТ служили адаптерами для иммобилизации лакказы Catenuloplanes japonicus ВКМ Ас-875 на поверхности электродов, изготовленных из графитовых стержней и графитовой пасты. Электрохимические свойства электродов проверяли в линейных и циклических вольтамперометрических измерениях для определения окислительно-восстановительного потенциала фермента и достижимых плотностей тока. Окислительно-восстановительный потенциал фермента превышал 500 мВ по сравнению с NHE, а максимальные плотности тока достигали сотен мкА/см2. Модельные биотопливные элементы на основе лакказных катодов имели максимальные значения мощности от 0,4 до 2 мкВт. Обсуждалась возможность практического применения таких БТЭ. | 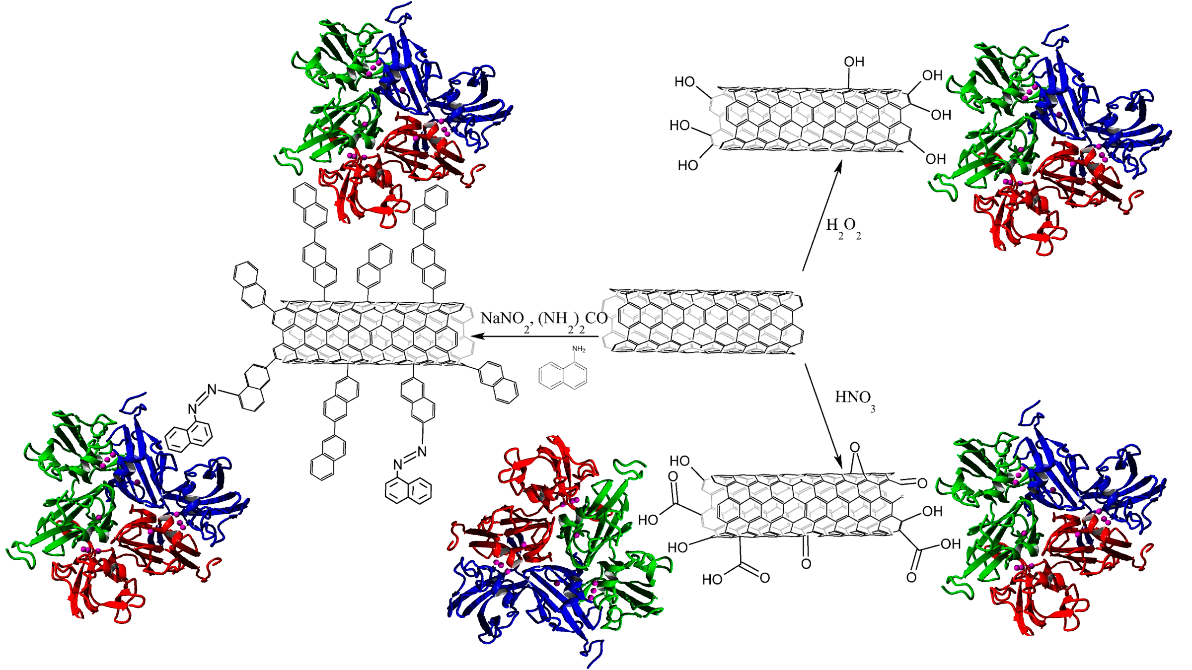 |
| Functionalization of Carbon Nanotubes Surface by Aryl Groups: A Review. Oskin, P.; Demkina, I.; Dmitrieva, E.; Alferov, S. Functionalization of Carbon Nanotubes Surface by Aryl Groups: A Review. Nanomaterials 2023, 13, 1630. https://doi.org/10.3390/nano13101630 Углеродные нанотрубки (УНТ) являются современным материалом, который, с момента их открытия в 1993 году широко используются в различных сферах человеческой деятельности. Было получено большое число разнообразных форм УНТ. Ввиду сильного Вандер-Ваальсового взаимодействия между ароматическими системами УНТ «слипаются» в плотные агрегаты, что делает их практически нерастворимыми, из-за чего значительно усложняется создание композитных материалов на их основе. Для решения этой проблемы было предложено использовать различные методы функционализации поверхности УНТ, благодаря чему происходит ослабление межмолекулярных взаимодействий. Арилированные нанотрубки отличаются повышенной растворимостью и широко используются в фотоэлектронике, полупроводниковой технике и биоэлектрокатализе. Обзорная статья обобщает результаты современных исследований по методам арилирования углеродных нанотрубок по радикальному механизму. В обзоре упор делается на методы введения арильных радикалов по реакциям Гомберга-Бахмана и Биллапса, а также разложением пероксидов. В то же время рассматриваются и менее распространенные подходы. Для каждой из описанных реакций представлен механизм в контексте влияния на свойства функционализированных нанотрубок и их применения. В результате это позволит выбрать оптимальный метод модификации для конкретных практических задач. | 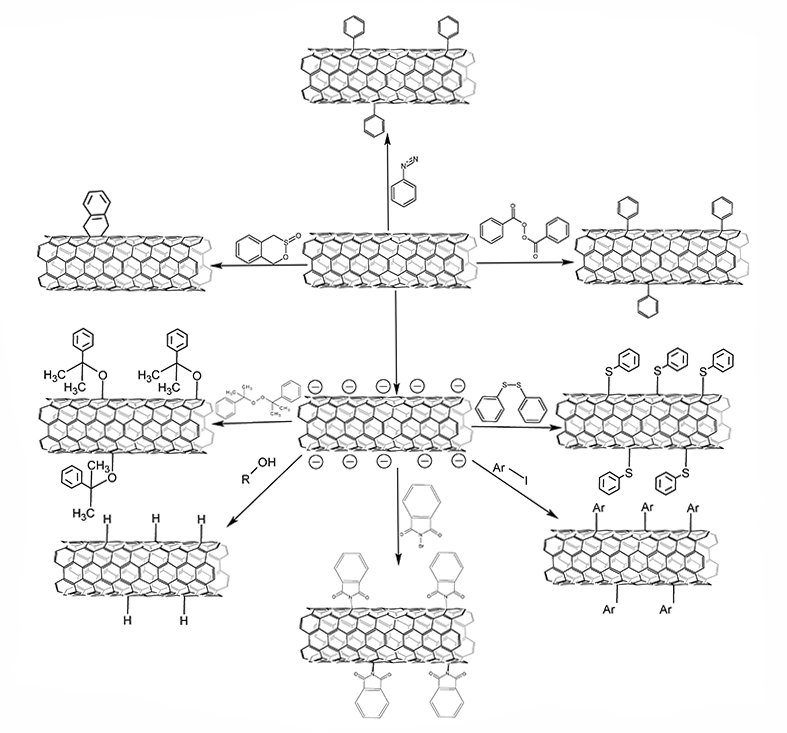 |
| Polymer-Based Conductive Nanocomposites for the Development of Bioanodes Using Membrane-Bound Enzyme Systems of Bacteria Gluconobacter oxydans in Biofuel Cells Fedina, V.; Lavrova, D.; Dyachkova, T.; Pasko, A.; Zvonarev, A.; Panfilov, V.; Ponamoreva, O.; Alferov, S. Polymer-Based Conductive Nanocomposites for the Development of Bioanodes Using Membrane-Bound Enzyme Systems of Bacteria Gluconobacter oxydans in Biofuel Cells. Polymers 2023, 15, 1296. https://doi.org/10.3390/polym15051296 Разработка биотопливных элементов (БТЭ) в настоящее время имеет большой потенциал, поскольку эти устройства могут использоваться в качестве альтернативных источников энергии. В данной работе исследуются перспективные материалы для иммобилизации биоматериалов в биоэлектрохимических устройствах на основе сравнительного анализа энергетических характеристик (генерируемый потенциал, внутреннее сопротивление, мощность) биотопливных элементов. Биоаноды формируют путем иммобилизации мембраносвязанных ферментных систем бактерий Gluconobacter oxydans ВКМ В-1280, содержащих пирролохинолинхинонзависимые дегидрогеназы, в гидрогели композитов на основе полимеров с углеродными нанотрубками. В качестве матриц используются природные и синтетические полимеры, а в качестве наполнителей – многостенные углеродные нанотрубки, окисленные в парах перекиси водорода (MWCNTox). Отношение интенсивностей двух характерных пиков, связанных с присутствием атомов С в sp3- и sp2-гибридизации для исходного и окисленного материалов, составляет 0,933 и 0,766 соответственно. Это доказывает пониженную степень дефектности MWCNTox по сравнению с исходными нанотрубками. MWCNTox в биоанодных композитах значительно улучшают энергетические характеристики БТЭ. Гидрогель хитозана в композиции с MWCNTox является наиболее перспективным материалом для иммобилизации биокатализатора для разработки биоэлектрохимических систем. Максимальная плотность мощности составила 1,39·10–5 Вт/мм2, что в 2 раза превышает мощность БТЭ на основе других полимерных нанокомпозитов. | 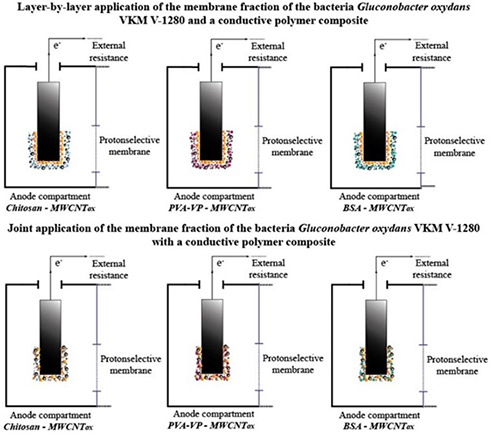 |
| Biocompatible Silica-Polyethylene Glycol-Based Composites for Immobilization of Microbial Cells by Sol-Gel Synthesis Lavrova, D.G.; Zvonarev, A.N.; Alferov, V.A.; Khonina, T.G.; Shadrina, E.V.; Alferov, S.V.; Ponamoreva, O.N. Biocompatible Silica-Polyethylene Glycol-Based Composites for Immobilization of Microbial Cells by Sol-Gel Synthesis. Polymers 2023, 15, 458. https://doi.org/10.3390/polym15020458 Разработаны биокатализаторы на основе метилотрофных дрожжей Ogataea polymorpha ВКМ Y-2559, иммобилизованных в нанокомпозиты на полимерной основе, для очистки метанол-содержащих сточных вод. Кремнийорганические композиты с различным соотношением матрицы и наполнителя, полученные из тетраэтоксисилана (ТЭОС), метилтриэтоксисилана (МТЭС) в присутствии полиэтиленгликоля (SPEG-композит) и из полиэтиленгликоля кремния (STPEG-композит), отличаются структурой силикатной фазы и ее распределением в композитной матрице. Методы флуоресцентной и сканирующей микроскопии впервые подтвердили образование кремнийорганической оболочки вокруг живых дрожжевых клеток при синтезе золь-гель биоSTPEG-композита. Инкапсулированные микробные клетки защищены от ультрафиолетового излучения и токсического действия ионов тяжелых металлов. Биофильтры на основе разработанных биокатализаторов характеризуются высокой эффективностью утилизации сточных вод, богатых метанолом – их окислительная способность достигала 900 gO2/(м3×цикл), степень очистки составляла до 60%. | 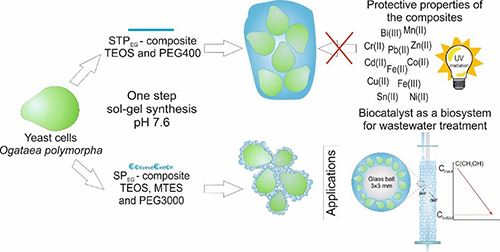 |
Партнеры
- ООО «ПромБиТ» (ПромБиотехнологии) – Инновационное предприятие индустриальной площадки в г. Ефремов по глубокой переработке зерна и выпуску пищевых и кормовых ингредиентов с использованием инновационных биотехнологий. (https://prombiotech.ru)
- ГК «БИОМ» – предприятие использует естественные природные механизмы для создания средств защиты растений и продуктов для улучшения экологии. (https://www.biom-group.ru/)
Контакты
- адрес: 300012, г. Тула, ул. Ф. Энгельса, 157, ауд. 202;
- телефон: 8 (4872) 25-24-90;
- электронная почта: ecobiolab@yandex.ru


